Número atual: 22(1) - Março 2022
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Alterações hematológicas na criança infectada pelo vírus da imunodeficiência humana
Hematological alterations in children infected with human immunodeficiency virus
Flávia Yasmine Elias1; Tony Tannous Tahan2; Andrea Maciel de Oliveira Rossoni2
DOI:10.31365/issn.2595-1769.v22i1p7-14
1. Universidade Federal do Paraná, Curso de Medicina - Curitiba - Paraná - Brasil
2. Universidade Federal do Paraná, Departamento de infectologia pediátrica - Curitiba - Paraná - Brasil
Endereço para correspondência:
Recebido em: 18/12/2020
Aprovado em: 27/09/2021
Instituição: Universidade Federal do Paraná, Curso de Medicina - Curitiba - Paraná - Brasil
Resumo
OBJETIVOS: Determinar a prevalência de alterações hematológicas em crianças com resultado positivo para infecção pelo vírus da imunodeficiência humana, bem como suas causalidades e condutas.
MÉTODOS: Estudo observacional, analítico, transversal, com coleta de dados retrospectiva. A amostra foi composta pelos pacientes em acompanhamento no serviço de infectopediatria de um hospital terciário no Paraná, de janeiro de 2002 a setembro de 2018. a pesquisa foi aprovada pelo Comitê de Ética e Pesquisa em Seres Humanos da referida instituição.
RESULTADOS: Foram incluídos todos os 56 pacientes que estavam em acompanhamento no período, sendo 53,57% meninas e 50% com idade de 11-15 anos. Ao longo do acompanhamento, 42,86% apresentaram uma ou mais alteração no hemograma. As principais alterações encontradas foram: 16,06% anemia; 23,21% macrocitose e 10,71% plaquetopenia. Fizeram uso de Zidovudina 85% dos estudados, em algum momento do tratamento (p=0,268). Todos os pacientes com macrocitose constavam como bons aderentes ao tratamento (p=0,018). Em 75% das alterações, a conduta foi expectante.
CONCLUSÕES: Foram encontradas alterações nas três séries do hemograma, com predominância da eritrocitária. A anemia e a macrocitose foram as mais prevalentes e para a grande maioria das alterações não houve necessidade de intervenções, reforçando a segurança da terapêutica instituída.
Palavras-chave: Crianças. Macrocitose. AZT. Infecções por HIV. Doenças hematológicas.
Abstract
OBJECTIVES: To determine the prevalence of hematological alterations in children with a positive result for infection by the Human Immunodeficiency Virus, as well as its causalities and conducts.
METHODS: Observational, analytical, transversal study with retrospective data collection. The sample consisted of patients being monitored at the pediatric infectious disease service of a tertiary hospital in Paraná state, Brazil, from January 2002 to September 2018. Research was approved by the Ethics and Research in Human Beings Committee of the aforementioned institution.
RESULTS: All 56 patients who were being followed up during the period were included, 53.57% were girls and 50% were 11-15 years old. During follow-up, 42.86% had one or more changes in the blood count. The main alterations found were: 16.06% anemia; 23.21% macrocytosis and 10.71% thrombocytopenia; 85% of those studied used Zidovudine at some point of the treatment (p=0.268). All patients with macrocytosis were found to be good adherents to the treatment (p=0.018). In 75% of the changes, the management was expectant.
CONCLUSIONS: Changes were found in the three series of the blood count, with predominance of the erythrocytes. Anemia and macrocytosis were the most prevalent and for most alterations there was no need for interventions, reinforcing the safety of the adopted therapeutics.
Keywords: Children. Macrocytosis. AZT. HIV Infections. Hematologic diseases.
INTRODUÇÃO
O vírus da imunodeficiência humana (HIV) é um retrovírus cujos subtipos HIV-1 e HIV-2 têm como característica a infecção via receptor CD4+ (do inglês, grupamento de diferenciação 4), uma proteína expressa na superfície de células do sistema imune: predominantemente linfócitos T, além de monócitos/macrófagos e células dendríticas/de Langerhans. A transmissão ocorre por relação sexual, sangue e hemocomponentes, e pela via vertical (intraparto e perinatal ou durante o aleitamento materno).1
Conforme o boletim epidemiológico de HIV/AIDS 2020 do Ministério da Saúde, no período de 2007 a junho de 2020, no Brasil, foram notificados 13.238 casos de infecção pelo HIV em indivíduos abaixo de 19 anos, o que representa 5,6% do total de notificações, com queda gradativa ao longo dos anos. No período de 2000 até junho de 2020, foram notificadas 134.328 gestantes infectadas com HIV, sendo que entre 2009 e 2019, houve um aumento de 21,7% nessa população, com uma porcentagem de detecção de 2,8/mil nascidos vivos. Esses dados são diretamente relacionados com a principal forma de infecção na faixa etária pediátrica, atualmente representada pela transmissão vertical.
Atualmente, é mandatório o tratamento de todos os indivíduos infectados com combinação de pelo menos três drogas de duas classes distintas (HAART do inglês, terapia antirretroviral altamente eficaz; TARV do português, terapia antirretroviral). Esta medida fornece a melhor oportunidade para preservar a função imunológica e retardar a progressão dessa infecção crônica e potencialmente fatal.2,3
Apesar dos grandes avanços na expectativa e qualidade de vida com a TARV, as crianças vivendo com HIV ainda são acometidas com muitas comorbidades, relacionadas tanto à infecção em si quanto à medicação empregada, especialmente em países em desenvolvimento, cuja subnutrição é uma realidade comum e que corrobora a acentuação dos índices de morbidade. Nesse contexto, apesar da inquestionável redução da taxa de mortalidade, os eventos adversos potencialmente relacionados ao tratamento têm se tornado o desafio da atualidade. 4,5
Por se tratar de uma doença multissistêmica, dentre as afecções, as gastrointestinais, metabólicas, hepáticas, do sistema nervoso central, lipodistróficas, osteopênicas, renais e hematológicas constituem as mais presentes na faixa etária pediátrica.2,6
Não obstante as alterações hematológicas estarem entre as manifestações clinicopatológicas mais comuns da infecção pelo HIV e serem mais frequentes e graves nas crianças do que nos adultos, elas têm sido documentadas como a segunda maior causa de morbimortalidade em pacientes vivendo com o vírus.7,8 Isto posto, a anemia é a alteração mais prevalente, considerando principalmente o período que antecede o início da terapia antirretroviral, fato que justifica a necessidade de coleta seriada de hemogramas neste grupo de pacientes.9,10,11
Infecções oportunistas, mielossupressão por antirretrovirais como a Zidovudina (AZT) ou relacionada ao próprio HIV estão entre as causas e/ou riscos associados para o desenvolvimento de anemia, leucopenia e trombocitopenia, tanto anteriormente quanto ao longo do uso da TARV.8,9
Um considerável número de estudos tem sido desenvolvido no que tange a citopenias em adultos infectados com HIV antes e após o início do tratamento.12,13 No entanto, a quantidade de trabalhos envolvendo tal assunto em crianças é limitado, especialmente em parâmetros nacionais.
Neste aspecto, este estudo teve como objetivo levantar dados sobre prevalência e possíveis causas e condutas nas alterações hematológicas desta população específica, a fim de corroborar a crescente necessidade de qualidade científica e, especialmente, de estudos locais no tema.
MÉTODOS
Tipo de estudo
Trata-se de estudo observacional, analítico, transversal, retrospectivo, com análise de prontuários.
População e local do estudo
A população consta dos pacientes acompanhados no ambulatório de HIV do serviço de infectologia pediátrica do Complexo Hospital de Clínicas (CHC-UFPR). Já passaram por este serviço aproximadamente 400 pacientes (entre crianças e adolescentes), desde sua inauguração em 1994. Destes, a maioria está em acompanhamento na infectologia adulto, alguns foram transferidos para outros serviços e uma minoria foi a óbito.
Critérios de inclusão e exclusão
Até o momento da coleta de dados, foram incluídos todos os 56 indivíduos em vigência de tratamento no ambulatório, cujos dados foram analisados do período de janeiro de 2002 a setembro de 2018. Os critérios de exclusão foram os prontuários com dados essenciais incompletos ou inconclusivos; todos os prontuários, entretanto, apresentaram-se elegíveis para o estudo.
Instrumentos de coleta de dados e testes laboratoriais
As informações foram coletadas seguindo variáveis demográficas: sexo, cor, idade e se sob cuidados familiares ou institucionais. A via de infecção foi avaliada e categorizada em vertical (intraútero/periparto e aleitamento materno) e desconhecida. Critérios específicos da infecção pelo HIV, como imunológicos (%CD4+) e virológicos (carga viral), ambos em dois momentos - no início do acompanhamento e no momento da coleta de dados - também foram analisados. A carga viral foi considerada indetectável abaixo de 50 cópias/ml e os valores de CD4+ (utilizados em porcentagem, para equiparação entre sexos e idades e calculada pela razão entre valor absoluto de CD4+ e linfócitos totais) foram divididos em: imunossupressão grave (<15%), moderada (15-25%) e imunossupressão ausente/imunocompetência (>25%), conforme classificação do Center for Deseases Control (1994).
Outro objeto de coleta para análise foi a terapia antirretroviral utilizada (considerando as combinações), número e motivos das trocas de TARVs e efetividade da adesão ao tratamento (boa ou ruim, conforme análise do médico responsável pelo acompanhamento). Os medicamentos utilizados fazem parte do arsenal permitido para crianças e adolescentes infectados pelo HIV, dentre eles: inibidores da transcriptase reversa - ITR - (Zidovudina, Lamivudina, Abacavir, Efavirenz, Nevirapina e Tenofovir), inibidores de protease - IP - (Lopinavir, Ritonavir, Atazanavir e Darunavir) e inibidores de integrase - II - (Raltegravir e Dolutegravir). As combinações são de acordo com a faixa etária, o estado clínico-imunológico e orientadas pelo Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em crianças e adolescentes do Ministério da Saúde, segundo o ano vigente.
As informações dos hemogramas sequenciais foram categorizadas entre normal e anormal para a idade nos parâmetros de plaquetograma, leucograma e eritrograma. Além disso, quando possível, objetivamos estabelecer, por meio das informações coletadas no prontuário e também pela análise estatística, a causalidade e a conduta decorrente em cada alteração hematológica apresentada. Para os parâmetros de normalidade dos hemogramas, utilizamos os valores disponibilizados pelo Programa Nacional de Controle de Qualidade (PNCQ), adequado às várias faixas etárias presentes na população de estudo e utilizado pelo laboratório de análises clínicas do CHC-UFPR.
Análise estatística
Os dados foram coletados em formulário específico, compilados em planilha do Microsoft Excel® 2007 e submetidos a análise estatística no programa STATA® versão 12.0. Os resultados foram descritos por meio de textos, gráficos e tabelas. Para as variáveis quantitativas, foram avaliados: média (± desvio padrão) ou mediana (máx/min); para as variáveis qualitativas: frequências e porcentagens. As análises comparativas das variáveis independentes foram realizadas com os testes não paramétricos: Qui quadrado de Pearson, Exato de Fisher e de McNemar. Em todas as análises, considerou-se um nível de significância de 5%.
Critérios éticos
O projeto de pesquisa foi aprovado pelo Comitê de Ética do Hospital (parecer n. 2.568.963, aprovação em 28/03/2018).
RESULTADOS
A amostra foi composta por 56 pacientes, 30 (53,57%) do sexo feminino. Em relação à idade, metade estava na faixa entre 11-15 anos; 18 (32,14%) no intervalo de 6-10 anos, 9 (16,07%) entre 2-5 anos e havia somente um (1,79%) lactente na amostra. Cinquenta e dois indivíduos (92,86%) eram da cor branca, 2 (3,57%) pretos e 2 (3,57%) pardos.
Trinta e três (58, 93%) dos menores vinham às consultas acompanhados pelo pai e/ou mãe biológicos, 14 (25%) em companhia de outro familiar, 6 (10,71%) eram adotados e 3 (5,36%) institucionalizados.
Em relação à via de transmissão do HIV, 45 (80,36%) adquiriram a infecção via vertical - intraútero/intraparto, 8 (14,29%), via vertical - leite materno e em 3 pacientes (5,36%) a via foi desconhecida.
Para carga viral, nenhum paciente apresentava indetecção ao diagnóstico e evolutivamente 41 (73,21%) pacientes a indetectaram (p<0,001) (Gráfico 1). Já para o CD4+, de 23 (41,07%) para 46 (82,14%) passaram a ser imunocompetentes (p<0,001), conforme evidenciado no Gráfico 2.
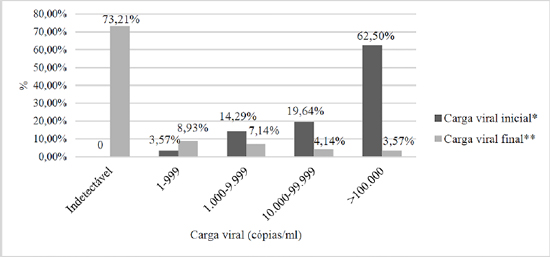
Gráfico 1. Cargas virais inicial e final em crianças com hiv acompanhadas em hospital de referência.
*No início do tratamento antirretroviral. **No momento da coleta de dados.
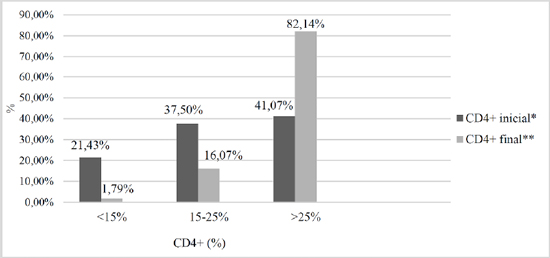
Gráfico 2. Valores de CD4+ Inicial e final em crianças com HIV acompanhadas em hospital de referência. *No início do tratamento antirretroviral. **No momento da coleta de dados.
Quanto à terapia antirretroviral, foram contabilizadas todas as combinações que os pacientes já haviam feito ao longo de seu tratamento no hospital. O número de trocas necessárias por paciente ao longo do acompanhamento ambulatorial variou de nenhuma até mais que quatro, sendo que a mediana foi de duas trocas. Nove (16,07%) usaram apenas uma combinação ao longo do período analisado, 44 (78.58%) usaram entre 2-4 combinações e 3 (5.36%) necessitaram de quatro ou mais trocas de esquemas medicamentosos.
Nesse aspecto, vários foram os motivos para as múltiplas necessidades de troca, algumas com mais de uma indicação. Dez (21,28%) trocaram por recomendação do Ministério da Saúde, 14 (29,79%) por questões de simplificação e/ou otimização, 23 (48,94%) para melhorar a adesão, 10 (21,28%) por eventos adversos não hematológicos (como exantema medicamentoso, lipodistrofia e dislipidemia), 6 (12,77%) indicadas por genotipagem e 7 (14,89%) por alteração hematológica.
Em relação às combinações de antirretrovirais, 42 (75%) pacientes já haviam feito o uso da combinação de ITRs. Trinta e nove (69,64%) já haviam usado ITR + IP. Apenas um (1,79%) usou ITR + II e 3 (5,36%) dos estudados usaram outras combinações ao longo do acompanhamento. Especificamente quanto ao uso do AZT (como parte da combinação), 48 (85,71%) dos 56 pacientes fizeram seu uso em algum momento do tratamento. Quarenta e duas crianças (75%) foram classificadas como tendo boa adesão ao tratamento.
Dos 56 pacientes, 24 (42,86%) apresentaram uma ou mais alterações no hemograma durante o acompanhamento ambulatorial. Trinta e dois (57,14%) não apresentaram nenhuma alteração, 9 (37,5%) apresentaram uma alteração, 3 (12,5%), duas alterações, 4 (16,66%), três alterações e 8 (33,33%), quatro ou mais alterações hematológicas.
As alterações específicas classificadas quanto à série hematológica alterada estão expostas na Tabela 1.
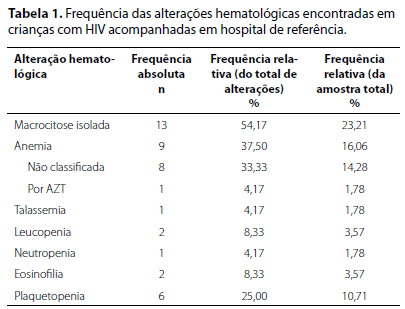
Dos 24 pacientes que apresentaram alteração hematológica, 19 (79,16%) fizeram uso da Zidovudina antes da anormalidade hematológica; e dos 32 que não apresentaram alterações, 29 (90,06%) utilizaram esta medicação (p=0,268). Dos 13 que apresentaram macrocitose, 12 (92,31%) haviam feito uso anterior do AZT, enquanto 36 (83,72%) usaram este medicamento e não tiveram alteração no volume corpuscular médio (VCM) (p=0,665).
A etiologia da alteração hematológica foi descrita em 12 prontuários, 5 (41,67%) como causas fisiológicas, 6 (50,00%) como o próprio HIV, 1 (4,16%) como genética e 1 (4,16%) como uso do AZT (anemia por AZT).
Todos os pacientes com macrocitose constavam como bons aderentes ao tratamento (p=0,018). Da mesma forma, todos os institucionalizados tiveram boa aderência (p=0,304). Destes, 2 (66,67%) tiveram macrocitose (p=0,067).
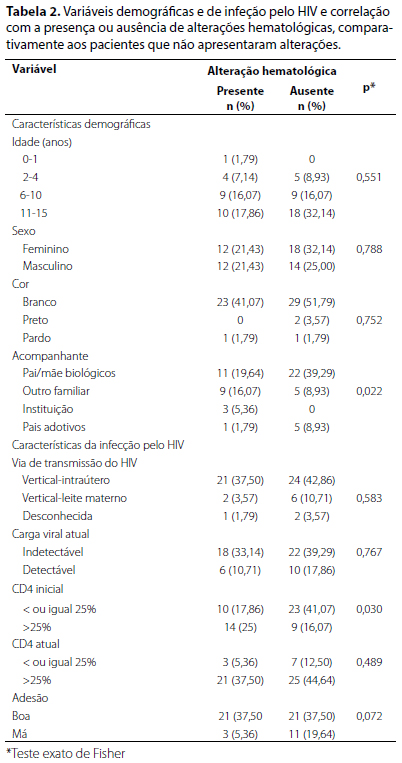
Considerando as 31 medidas terapêuticas tomadas nos 24 pacientes com alterações, 14 (45,16%) foram expectantes. Sete (22,58%) constituíram na troca ou retirada da combinação de antirretrovirais que estava sendo administrada. Em contrapartida, para 1 (3,22%) paciente a medida foi a introdução da terapia antirretroviral. Oito medidas foram mais especializadas: 4 (12,90%) encaminhamentos para o serviço de hematologia e 4 (12,90%) transfusões de hemoderivados. Por fim, um paciente (3,22%) recebeu sulfato ferroso. Os demais resultados referentes à estatística inferencial constam na Tabela 2.
DISCUSSÃO
Em nosso estudo, metade das crianças da amostra se encontrava na faixa etária de 11-15 anos, ao contrário dos estudos de Ebonyi et al. (2017) e Tsegay et al. (2017), cujas prevalências de idade concentravam-se entre 6-10 anos. Isto pode ser explicado pelo fato de ambos os estudos terem sido realizados no continente africano, onde apesar da significativa redução, as taxas de infecção ainda são numerosas e contínuas.14,15
Para aproximadamente três quartos dos pacientes, houve significativa indetecção da carga viral e concomitante aumento do valor de CD4+, e apenas uma estava abaixo dos 2 anos de idade, o que reflete os baixos índices atuais de infecção vertical com a terapia antirretroviral de qualidade oferecida para gestante infectada.
Considerando toda a série história de notificação de casos no Brasil, a Região Sul apresentou as maiores taxas de detecção de HIV em gestantes no país. Esse dado pode ser explicado, em parte, pela ampliação do diagnóstico no pré-natal e tem como consequência a possibilidade de prevenção da transmissão mãe-filho do HIV. Curitiba, em 2017, ganhou certificação de primeira capital do Brasil com eliminação da transmissão vertical do HIV,16 certificação que advém de uma das muitas estratégias para a redução da epidemia desta doença. A maior e mais importante delas é a meta 90-90-90, a qual, em 2016, na Declaração Política da Assembleia Geral das Nações Unidas sobre o Fim da Aids, os países se comprometeram para que, até 2020, 90% de todas as pessoas vivendo com HIV tivessem seu diagnóstico, 90% recebessem terapia antirretroviral ininterruptamente e 90% de todas as pessoas recebendo TARV obtivessem indetecção viral.17
A porcentagem de crianças com alterações hematológicas em todos os parâmetros se apresentou menor que o esperado, uma vez que estas constam como uma das mais frequentes na infecção pelo HIV.2,6 Especificamente quanto à anemia, que é a mais prevalente, nossa incidência (16,06%) se mostrou menor que a média de outros estudos mundiais: Nigéria (38.2%), Quênia (35.9%), Índia (69%) e Nepal (74,4%) e também brasileiros: Campinas (67,36%).5,18,19,20,21
A discrepância no que concerne aos estudos estrangeiros pode ser explicada por diferenças étnicas, medicações empregadas e sua adesão, políticas públicas de manejo do HIV, infecções prevalentes locais (como a malária), estado nutricional dos pacientes e características próprias de cada projeto de pesquisa.22 E, comparando com o estudo brasileiro, realizado em 1999, podemos atribuir além das possibilidades já expostas, o fato de que o controle das manifestações tanto do HIV quanto dos efeitos colaterais da TARV tem sido mais efetivo nos últimos anos, o que pode explicar nossa porcentagem reduzida de anemia e também de outros achados hematológicos.
Na pesquisa brasileira de Silva et al. (1999), já mencionada, os autores trazem uma discussão que pode ser reproduzida igualmente na nossa realidade: não foram utilizados parâmetros suficientes para distinguir a anemia como meramente nutricional e do desenvolvimento (ferropriva) da causada por doença crônica (infecção pelo HIV), especialmente se houve prescrição anterior de sulfato ferroso. Para evitar interpretação equivocada, seria prudente avaliar o estoque de ferro medular, pois no caso de doenças que cursam com inflamação, a concentração de ferritina é elevada em um grau desproporcional aos estoques de ferro, parâmetros estes que não constaram em nossa metodologia.23,24
Em relação a leucopenia e neutropenia, encontramos a prevalência de 3,57% e 1,78%, respectivamente, e não tivemos pacientes com linfopenia. Novamente, esses valores se mostraram inferiores a estudos anteriores.14,15 Podemos atribuir os bons índices encontrados na análise do funcionamento do serviço ao efeito positivo da TARV na redução da carga viral, diminuição da destruição de células hematopoiéticas maduras de múltiplas linhagens, controle frequente dos níveis hematológicos pela realização de hemogramas seriados e, sobretudo, em se tratando de células brancas, da diminuição da incidência de infecções oportunistas durante o tratamento.6,9,11
Para a plaquetopenia, obtivemos a prevalência de 10,71%. Este valor é condizente com outros estudos, principalmente os que comparam o número de plaquetas antes e após o início da TARV ou na presença de imunossupressão e imunocompetência, uma vez que para a maioria de nossos pacientes, o achado de trombocitopenia foi concomitante ao diagnóstico da infecção pelo HIV.14,15,26 Neste segmento, como nossa amostra é referente a 16 anos de acompanhamento, muitos pacientes foram diagnosticados por meio de um sintoma evolutivo da infecção pelo HIV, dentre eles a púrpura trombocitopênica. Na atualidade, obtém-se o diagnóstico da criança infectada mais precocemente e com o tratamento antirretroviral imediato, a incidência deste achado tende a diminuir substancialmente.28
Mais de 70% dos que apresentaram alteração hematológica haviam feito uso anterior de AZT. Além de este valor ser condizente com a literatura estrangeira, este é um assunto também abordado em nível nacional.15,27 Apesar da indiscutível contribuição do AZT na pediatria nas últimas décadas, o Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Crianças e Adolescentes (2018) traz como medida a retirada gradual deste ITR das combinações de antirretrovirais, assim como já é realizado na população adulta.28 Evidências mostram que a Zidovudina causa hipoplasia eritroide, aplasia e maturação megaloblástica, que pode ser acompanhada por aumento progressivo no VCM e também anemia. Além disso, o aumento deste parâmetro eritrocitário pode mostrar um incremento de suplementação de ferro e modificações nutricionais que ocorrem após o início da terapia antirretroviral.29,30
Ainda neste aspecto, evidenciou-se no estudo que a maior parte das alterações hematológicas foi a macrocitose. Este resultado está em conformidade com outros trabalhos, e pode ser explicado pelo uso do AZT como parte da TARV utilizada no tratamento da maioria das crianças infectadas pelo HIV.14,18,21,27 Apesar de haver significância estatística entre apresentar macrocitose e ter boa aderência ao tratamento, não encontramos significância ao relacionarmos macrocitose e uso anterior de AZT, provavelmente pelo fato de um grande número de crianças fazer uso desse medicamento.
Quanto à presença de alterações hematológicas, observou-se valor estatisticamente significativo para as crianças institucionalizadas. Esta informação não foi encontrada nos estudos revisados. Justificamos este achado pela possibilidade de a própria TARV ocasionar as anormalidades sanguíneas.14,27,30 Conforme demonstrado pela análise estatística, assumimos que a organização e disciplina presentes em uma instituição se traduzem em uma adequada administração da combinação medicamentosa, sendo que a maioria dessas crianças apresentou como alteração justamente a macrocitose. Entretanto, esta estatística inferencial não se mostrou significante, provavelmente devido ao número reduzido de crianças abrigadas presentes na amostra.
Corrobora esta afirmação o resultado também evidenciado de que pacientes com boa adesão apresentaram mais alteração no hemograma comparativamente àqueles que não eram efetivamente regulares na administração da TARV. Mais especificamente, obtivemos significância estatística para as crianças com macrocitose - principal alteração relacionada ao uso da TARV - que apresentaram boa adesão ao tratamento.
Para a grande maioria dos pacientes que apresentaram alteração hematológica, a conduta foi expectante, não sendo realizada a troca da TARV em vigência. Pela ausência deste dado na literatura revisada que possibilite comparação, inferimos que nosso resultado é referente ao fato de a maioria das alterações em nosso serviço serem justamente o aumento isolado do VCM, que não revela dano irreversível e necessidade imediata de conduta e, concomitantemente, pode ser utilizado como dado compatível a adesão e regularidade da terapêutica, pois, como mencionado, a etiologia principal é o ainda prevalente uso do AZT.15
Quanto às limitações encontradas na realização do estudo, destacamos principalmente a dependência de informações contidas em prontuário, que por vezes não estão preenchidos de forma correta e/ou completa. Pelo desenho do estudo, houve também a dificuldade em se estabelecer correlações como a causalidade da anemia.
Concluímos que o estudo demonstrou alterações nas três séries do hemograma, com predominância da eritrocitária e majoritariamente sem necessidade de intervenções. Apesar das limitações, trata-se de um estudo de relevância para o pediatra no manejo e acompanhamento da criança vivendo com HIV, especialmente na otimização da terapia antirretroviral no que tange às alterações hematológicas.
REFERÊNCIAS
1. Kasper DL, Fauci AS, Hauser SL, Longo DL, Jameson JL, Loscalzo J et al., editors. Harrison's principles of internal medicine. 19º ed. New York: McGraw Hill; 2017.
2. Panel on Antiretroviral Therapy and Medical Management of HIV-Infected Children [homepage da internet]. Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection, 2018 Oct [acesso em: 22 fev 2019]. Disponível em: http://aidsinfo.nih.gov/contentfiles/lvguidelines/pediatricguidelines.pdf.
3. Rivera, D. M; Frye, R. E. Pediatric HIV Infection [homepage da internet]. Medscape, drugs and deseases - pediatrics, 2018 Nov [acesso em 22 fev 2019]. Disponível em: https://emedicine.medscape.com/article/965086overview#a1.
4. Almeida FJ, kochi C, Sáfadi MAP. Influence of the antiretroviral therapy on the growth pattern of children and adolescents living with HIV/AIDS [revista em internet]. J pediatr (Rio J) 2018 Dez;764:1-7 [acesso em 22 fev 2019]. Disponível em: https://doi.org/10.1016/j.jped.2018.12.007.
5. Oshikoya KA, Lawal S, Oreagba IA, et al. Adverse events in HIV- infected children on antiretroviral therapy at a teaching hospital in Lagos, Nigeria: a retrospective study. Adv Pharmacoepidem Drug Safety 2012;1(4):100-17.
6. Leite OHM. Alterações hematológicas associadas a infecção pelo HIV, ainda um problema?. [revista em internet] Rev. Bras. Hematol. Hemoter 2010 Fev;32(1):3-4 [acesso em 21 fev 2019]. Disponível em: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1516-84842010000100002&lng=en. http://dx.doi.org/10.1590/S1516-84842010000100002.
7. Moses A, Nelson J, Bagby GC. The influence of human immunodeficiency virus-1 on hematopoiesis. Blood 1998;91(5):1479-95.
8. Sloand E. Hematologic complications of HIV infection. AIDS Rev. 2004;7(4):187-96.
9. Ellaurie M, Burns ER, Rubinstein A. Hematologic manifestations in pediatric HIV infection: severe anemia as a prognostic factor. Am J Pediatr Hematol Oncol 1990;12:449-53.
10. Adetifa IM, Temiye EO, Akinsulie AO et al. Haematological abnormalities associated with paediatric HIV/AIDS in Lagos. Ann Trop Paediatr 2006 Jun;26:121-25.
11. Bhowmik A, Banerjee P. Hematological manifestation in HIV infected children. J Coll Physicians Surg Pak 2015;25:119-23.
12. Aurpibul L, Puthanakit T, Sirisanthana T, Sirisanthana V. Haematological changes after switching from Stavudine to Zidovudine in HIV-infected children receiving highly active antiretroviral therapy. HIV Med. 2008;9:317-21.
13. Molye G, Sawyer W, Law M, Amin J, Hil A. Changes in hematologic parameters and efficacy of thymidine analogue-based, highly active antiretroviral therapy: a meta-analysis of six prospective, randomized, comparative studies. Clin Ther. 2004;26(1):92-7.
14. Tsegay YG, Tadele A, Addis Z, Alemu A, Melku M. Magnitude of cytopenias among HIV-infected children in Bahir Dar, northwest Ethiopia: a comparison of HAART-naïve and HAART-experienced children. HIV/AIDS - research and paliative care 2017 Feb;9:31-42.
15. Ebonyi AO, Oguche S, Ochoca MO, Agbaji OO, Anejo-Okopi JÁ, Abah IO, Okonkwo PI, Idoko JA. Changes in the haematological parameters of HIV-1 infected children at 6 and 12 months of antiretroviral therapy in a large clinic cohort, North-Central Nigeria. Journal of Virus Eradication 2017;3:208-11.
16. Departamento de vigilância, prevenção e controle das IST, do HIV/Aids e das hepatites virais, Ministério da Saúde [homepage da internet]. Curitiba recebe certificado da eliminação da transmissão vertical do HIV [acesso em 14 mar 2019]. Disponível em http://www.aids.gov.br/pt-br/noticias/curitiba-recebe-certificacao-de-eliminacao-da-transmissao-vertical-do-hiv.
17. Programa Conjunto das Nações Unidas sobre HIV/Aids [homepage da internet]. 90-90-90 Uma meta ambiciosa de tratamento para contribuir para o fim da epidemia de AIDS [acesso em 03/03/2019]. Disponível em: https://unaids.org.br/wp-content/uploads/2015/11/2015_11_20_UNAIDS_TRATAMENTO_META_PT_v4_GB.pdf.
18. Kibaru EG, Nduati R, Wamalwa D, Kariuki N. Impact of highly active antiretroviral therapy on hematological indices among HIV-1 infected children at Kenyatta National Hospital-Kenya: retrospective study. AIDS Res Ther Ago 2015;15:12-26.
19. Poudel P, Pokharel R, Chitlangia M, Chaudhary S. Profile of HIV infected children: a hospital based study at Eastern Nepal. Asian Pac J Trop Dis 2014;4(3):169-75.
20. Bhowmik A, Banerjee P. Hematological manifestation in HIV infected children. J Coll Physicians Surg Pak 2015;25(2):119-23.
21. Silva EB, Tresoldi MTNS, Vilela MMS. Evolução de parâmetros hematológicos em um grupo de crianças infectadas pelo vírus da imunodeficiência humana do tipo HIV 1. J Pediatr (Rio J) 1999;75(6):442-48.
22. Evans RH, Scadden DT. Haematological aspects of HIV infection. Baillieres Pract Res Clin Haematol 2000;13:215-30.
23. Abshire TC. The anemia of inflamation, a common cause of childhood anemia. Ped Clin N Am 1996;43:623-37.
24. Lipschitz DA, Cook JD, Finch CA. A clinical evaluation of serum ferritin as an index of iron stores. N Engl J Med 1974;290:1213-16.
25. Huang SS, Barbour JD, Deeks SG et al. Reversal of human immunodeficiency virus type 1-associated hematosuppression by effective antiretroviral therapy. Clin Infect Dis 2000;30:504.
26. Enawgaw B, Alem M, Addis Z, Melku M. Determination of hematological and immunological parameters among HIV positive patients taking highly active antiretroviral treatment and treatment naive in the antiretroviral therapy clinic of Gondar University Hospital, Gondar, Northwest Ethiopia: a comparative cross-sectional study. BMC Hematol 2014;14:8.
27. Ziske J, Kunz A, Sewangi J, Lau I, Dugange F, Hauser A, Kirschner W, Harms G, Theuring S. Hematological Changes in Women and Infants Exposed to an AZT-Containing Regimen for Prevention of Motherto-Child-Transmission of HIV in Tanzania [periódico da internet]. Plos One 2013 Fev [acesso em: 01 mar 2019]. Disponível em: https://journals.plos.org/plosone/article?id=10.1371/journal.pone.0055633.
28. Protocolo Clínico e Diretrizes Terapêuticas para Manejo da Infecção pelo HIV em Crianças e Adolescentes [homepage da internet]. Ministério da saúde - Brasilia, DF, 2018 [acesso em 02 mar 2019]. Disponível em: http://www.aids.gov.br/pt-br/pub/2017/protocolo-clinico-e-diretrizes-terapeuticas-para-manejo-da-infeccao-pelo-hiv-em-criancas-e-adolescentes.
29. Ssali F, Stohr W, Munderi P, et al. Prevalence, incidence and predictors of severe anaemia with zidovudine-containing regimens in African adults with HIV infection within the DART trial. Antivir Ther 2006;11:741.
30. Pryce C, Pierre RB, Steel-Duncan J, et al. Safety of antiretroviral drugs in Jamaican children with HIV. West Indian Med J. 2008;57(3):238-45.






