Número atual: 22(1) - Março 2022
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Triagem neonatal para erros inatos da imunidade com quantificação de trec e krec em recém-nascidos prematuros e a termo
Newborn screening for immunodeficiency using trec and krec at a maternity hospital in rio de janeiro
Priscila Feijó Klaes1; Fernanda Pinto Mariz1; Ekaterni Simões Goudouris1; Jusley Lira Sousa2; Lucila Akune Barreiros2; Antonio Condino Neto2
DOI:10.31365/issn.2595-1769.v22i1p21-28
1. Universidade Federal do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro - RJ - Brasil
2. Universidade de São Paulo, Instituto de Ciências Biomédicas - São Paulo - SP - Brasil
Endereço para correspondência:
Recebido em: 10/05/2021
Aprovado em: 03/09/2021
Instituição: Universidade Federal do Rio de Janeiro, Departamento de Pediatria - Rio de Janeiro - RJ - Brasil
Resumo
OBJETIVO: Aplicar teste de triagem para erros inatos da imunidade (EII), descrever resultados comparando diferenças entre nascidos prematuros e a termo, e achados clínicos associados.
MÉTODOS: Estudo descritivo no qual foram obtidas 384 amostras de sangue em papel filtro de recém-nascidos na Maternidade Escola da Universidade Federal do Rio de Janeiro (UFRJ) para quantificação do número de círculos excisados de receptores de células T (TREC, do inglês: T-Cell Receptor Excision Circles) e círculos excisados kappa-deleting (KREC, do inglês Kappa-deleting Recombination Excision Circles) com técnica de reação em cadeia de polimerase (polymerase chain reaction, PCR) em tempo real. As variáveis foram comparadas utilizando-se o teste de Mann-Whitney e consideradas significativas quando p < 0.05.
RESULTADOS: 383 amostras válidas, valores de TREC variando de 0 a 641 (mediana: 151, média: 169) e de KREC de 0 a 397 (mediana: 74, média: 86.5) moléculas por microlitro. Das 7 amostras com valores abaixo da normalidade, 6 foram repetidas. Não foi confirmado nenhum caso de imunodeficiência. Quantificações de TREC e KREC de prematuros foram significativamente menores que dos nascidos termo (p<0.0001 e p=0.03, respectivamente), entretanto, em relação ao KREC, não houve diferença entre prematuros a partir de 34 semanas e a termo (p=0.86).
CONCLUSÃO: A prematuridade influencia na quantificação de TREC e KREC, porém a grande maioria dos prematuros apresentou resultados normais, ressaltando a importância do exame mesmo nesses recém-nascidos. Os resultados sugerem que a repetição da avaliação de KREC em recém-nascidos prematuros, quando necessária, pode ser realizada a partir de 34 semanas.
Palavras-chave: Triagem neonatal. Agamaglobulinemia. Imunidade. Imunodeficiência combinada severa.
Abstract
OBJECTIVE: Apply a screening test for inborn errors of immunity (IEI), describe results comparing differences between preterm and full-term infants, and associated clinical findings.
METHODS: Descriptive study in which 384 blood samples were obtained on filter paper from newborns at the Maternity School of the Federal University of Rio de Janeiro (UFRJ) to quantify the number of excised circles of T cell receptors (TREC: T-Cell Receptor Excision Circles) and Kappa-deleting Recombination Excision Circles (KREC) with real-time polymerase chain reaction (PCR) technique. The variables were compared using the Mann-Whitney test and considered significant when p < 0.05.
RESULTS: 383 valid samples, TREC values ranging from 0 to 641 (median: 151, mean: 169) and KREC values from 0 to 397 (median: 74, mean: 86.5) molecules per microliter. Of the 7 samples with values below normal, 6 were repeated. No case of immunodeficiency was confirmed. Quantifications of TREC and KREC of preterm infants were significantly lower than that of term infants (p<0.0001 and p=0.03, respectively), however, in relation to KREC, there was no difference between preterm infants from 34 weeks and term (p=0.86).
CONCLUSION: Prematurity influences the quantification of TREC and KREC, but the vast majority of preterm infants had normal results, emphasizing the importance of the examination even in these newborns. The results suggest that repeat KREC assessment in preterm infants, when necessary, can be performed from 34 weeks onwards.
Keywords: Newborn screening. Agammaglobulinemia. Immunity. Severe combined immunodeficiency
INTRODUÇÃO
Os erros inatos da imunidade (EII), antes denominados imunodeficiências primárias, são doenças geneticamente determinadas que podem cursar com infecções graves ou de repetição, assim como manifestações de desregulação imune: alergias, inflamação, autoimunidade e/ou linfoproliferação e maior risco de malignidade.1 Compreendem mais de 404 doenças, que comprometem diferentes componentes do sistema imunológico, sendo descritas mutações em cerca de 430 genes. São consideradas raras, porém também subdiagnosticadas, sendo muitas de descoberta recente.2
Dentre os EII com comprometimento das respostas celular e humoral, existe o grupo das imunodeficiências combinadas graves, representadas pela sigla SCID, do inglês Severe Combined Immuno Deficiency. Nelas, o desenvolvimento e funcionamento dos linfócitos T são prejudicados, gerando significativo prejuízo no funcionamento do sistema imunológico e, consequentemente, infecções graves de repetição. Pode também haver efeitos variáveis sobre o desenvolvimento de linfócitos B e de células natural killers.2,3
Alguns lactentes com SCID podem aparentar ser saudáveis nos primeiros meses de vida, porém têm maior suscetibilidade para desenvolver infecções graves, inclusive após vacinação com micro-organismos vivos, particularmente a BCG.4 Uma outra parcela de lactentes pode apresentar desde o início da vida falha de crescimento, alterações hematológicas e dismorfismos sugestivos de síndromes associadas a erro inato da imunidade.5
SCID é uma emergência médica e o tratamento definitivo com transplante de células tronco-hematopoiéticas deve ser realizado preferencialmente antes dos três meses de idade.6 Em alguns casos, o óbito por infecção ocorre antes mesmo da descoberta da doença.7
Os defeitos na produção de anticorpos são as doenças mais frequentes dentre os EII. No caso da agamaglobulinemia ligada ao X, o defeito de produção da célula B é causado por uma mutação na enzima tirosina quinase de Bruton, acarretando parada de maturação do linfócito B na medula óssea e, consequentemente, ausência de linfócitos B circulantes na corrente sanguínea e escassez de imunoglobulinas. Logo após o nascimento, o organismo ainda está protegido por anticorpos maternos, que ultrapassam a barreira placentária, principalmente no terceiro trimestre de gestação, e garantem proteção nos primeiros meses de vida. Porém, ainda no primeiro ano, quando ocorre a redução da imunoglobulina G (IgG) oriunda da mãe, começam a surgir as infecções de repetição.8
Os círculos de excisão de recombinação de receptores de células T (TREC) são fragmentos de DNA que sobram durante o rearranjo intratímico do gene do receptor de células T que ocorre durante o processo de geração de uma nova célula. Sua quantificação permite estimar a quantidade de linfócitos T recém-gerados no timo.9 A quantidade diminuída reflete linfopenia de células T, que pode ter como causa a SCID (quando os níveis são indetectáveis) ou linfopenia de células T de outra etiologia.
Da mesma forma que os TREC surgem durante a formação dos linfócitos T, no processo de maturação dos linfócitos B na medula são formados os círculos de excisão do receptor da imunoglobulina Kappa de cadeia leve (KREC, do inglês Kappa Deleting Excision Circles). Assim, uma contagem baixa de KRE, pode refletir uma linfopenia de células B, cuja principal causa é a agamaglobulinemia ligada ao X.10 A técnica PCR duplex quantitativo em tempo real pode medir juntos TREC e KREC, permitindo avaliar a quantidade de linfócitos T e B recentemente produzidos. Esse método é utilizado em amostras de sangue coletadas em papel filtro e se tornou uma importante ferramenta para o diagnóstico precoce de EII.11
No Brasil, não sabemos a real incidência da SCID. Nossa referência são os dados de países onde essa triagem é universal, como nos Estados Unidos, onde se estima que a incidência de SCID pode ser de aproximadamente 1 a cada 58.000 nascidos.12 O primeiro artigo sobre a introdução da triagem para SCID no Brasil foi publicado em 201613 e relatou a aplicação da técnica de quantificação de TREC em uma população de recém-nascidos procedentes de maternidades de São Paulo e de Belém.
O objetivo do presente trabalho foi aplicar o teste de triagem neonatal, em papel filtro, visando identificar níveis de TREC e KREC em uma amostra de pacientes nascidos na maternidade escola da UFRJ. Além disso, procuramos correlacionar os resultados com dados de estudos anteriores, analisar as diferenças obtidas de exames de recém-nascidos prematuro e de termo, além de realizar avaliação clínica e laboratorial de pacientes que tiveram exames alterados, tentando esclarecer possíveis causas de TREC e KREC baixos.
MÉTODOS
Estudo transversal descritivo realizado com recém-nascidos admitidos na Maternidade Escola (ME) da UFRJ, entre novembro de 2017 e junho de 2019. Os cartões de coleta de sangue foram fornecidos pelo Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência, como parte da pesquisa do Instituto de Pesquisa PENSI e Instituto de Ciências Biomédicas da Universidade de São Paulo (PRONAS/PDC 2015, 25000.077928/2015-06).
As amostras de sangue foram coletadas em papel filtro 903, mantidas refrigeradas até o envio por correio para análise no Laboratório de Imunologia Humana (LIH), do Instituto de Ciências Biomédicas, localizado na Universidade de São Paulo (ICB-USP). O processamento das amostras foi feito por reação de cadeia de polimerase multiplex em tempo real, com purificação e extração do DNA, permitindo a quantificação de TREC e KREC, conforme descrições anteriores.14
Usamos como valor de corte, para considerar um resultado normal, a quantificação de TREC acima de 25/μl e KREC acima de 20/μl, referências do LIH. Os laudos dos testes eram recebidos por e-mail e encaminhados para os responsáveis.
Conforme definido na literatura, foram considerados nascidos a termo aqueles com idade gestacional maior ou igual a 37 semanas, e prematuros, aqueles com idade gestacional menor do que 37 semanas.15 Os prematuros foram divididos em três grupos: prematuro extremo (idade gestacional menor ou igual a 28 semanas), prematuro moderado (idade gestacional de 29 a 33 semanas) e prematuro tardio (idade gestacional de maior ou igual a 34 semanas e menor que 37 semanas). Nos recém-nascidos prematuros com quantificação de TREC e KREC alterada, o teste foi repetido apenas após 37 semanas de idade gestacional corrigida.
No caso de resultados alterados, após recebimento do laudo, foi feito contato imediato com os responsáveis e realizada coleta de segunda amostra em papel filtro. Nestes casos, as análises de TREC e KREC foram repetidas juntamente com um controle endógeno (β-actina) para avaliação da qualidade da amostra. Além disso, no caso de testes alterados em recém-nascido a termo, o paciente era imediatamente encaminhado para o ambulatório de Imunologia do IPPMG (unidade hospitalar pediátrica da UFRJ), para realizar o acompanhamento clínico e laboratorial. A rotina para a investigação de erros inatos da imunidade incluiu dosagem de imunoglobulinas A, M, G e E, além de subpopulações linfocitárias (linfócitos T, B e NK), exames processados pelo Laboratório de Análises Clínicas e pelo Laboratório Multidisciplinar do IPPMG.
Foram coletados dados demográficos e clínicos de todos os participantes do estudo (recém-nascidos e respectivas mães), incluindo: data de nascimento, sexo, idade gestacional, transfusão sanguínea para o recém-nascido, peso de nascimento, gemelaridade, malformações congênitas, resultado de hemograma, presença de timo em radiografia de tórax, história familiar sugestiva de imunodeficiência e consanguinidade dos pais.
As informações foram transpostas para um banco de dados criado no programa Microsoft Office Excel 2010 e foram utilizados para análise os programas Excel e GraphPad Prism 5. As variáveis estudadas foram analisadas de modo descritivo, expressas em frequência (número) e percentuais. Foram utilizadas medidas de tendência central para variáveis contínuas, como os resultados de TREC e KREC, com cálculo da mediana da amostra total e de cada faixa de idade gestacional separada por semanas.nPara a comparação de variáveis contínuas entre os grupos, foi aplicado o teste de Mann-Whitney. O resultado foi considerado significativo quando valores de p ≤ 0.05.
O projeto, intitulado "Triagem neonatal, intervenção precoce, aconselhamento genético e estudo epidemiológico", foi aprovado pelo CEP da ME da UFRJ e do Instituto de Puericultura e Pediatria Martagão Gesteira (IPPMG) (CAAE: 45926215.0.3006.5275 e 45926215.0.1001.5264, respectivamente). Foram incluídos no estudo aqueles recém-nascidos cujos responsáveis assinaram o TCLE autorizando a coleta do exame.
RESULTADOS
Foram coletadas amostras de 384 recém-nascidos e apenas um foi excluído do estudo, pois teve um resultado inconclusivo para dosagem de TREC e KREC, e não foi possível contactá-lo para nova testagem. Dentre os 383 recém-nascidos avaliados, 194 eram do sexo feminino, 187 masculino, 2 foram classificados como sexo indeterminado, devido à presença de genitália ambígua. Segundo a idade gestacional, 105 participantes nasceram prematuros (27,4%) e 278, a termo (72,6%). A média da idade gestacional dos recém-nascidos estudados foi de 37 semanas e 5 dias, com mediana de 38 semanas e 3 dias.
Os valores de TREC variaram de 0 a 641 moléculas por microlitro, e de KREC de 0 a 397 moléculas por microlitro. Dentre todas as amostras coletadas, a média dos resultados de TREC foi 169 e de KREC, 86,5, com medianas de 151 e 74, respectivamente.
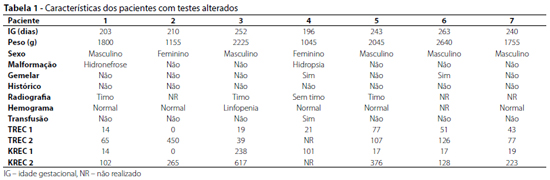
Sete recém-nascidos (1,8%) apresentaram valores abaixo da normalidade na primeira testagem. As variáveis desses pacientes que tiveram resultados com baixos valores de TREC e KREC foram analisadas e estão ilustradas na tabela 1. Esses sete pacientes foram reconvocados para realizar uma segunda coleta em papel filtro. Não foi possível repetir a análise em apenas um dos pacientes, que faleceu por complicações decorrentes de prematuridade e hidropsia fetal por transfusão feto-fetal. Todos os demais exames coletados para uma segunda dosagem de TREC e KREC revelaram quantificações normais.
Um dos participantes do estudo tinha história familiar positiva para EII: seu meio-irmão (por parte de mãe) é portador de agamaglobulinemia ligada ao X. Apesar de ter apresentado níveis de TREC e KREC normais, considerando a história familiar, ele foi encaminhado para o ambulatório de imunologia do IPPMG. Nesse acompanhamento, apresentou dosagens de imunoglobulinas e subpopulações linfocitárias normais.
Também foram referenciados para o ambulatório de imunologia do IPPMG outros dois pacientes, irmãos gêmeos, pois um deles teve quantificação de KREC abaixo do normal. Deste, foi coletada nova amostra em papel filtro (com resultado normal) e realizada dosagem de imunoglobulinas, com resultados dentro da normalidade. O irmão, apesar do teste em papel filtro normal, também foi submetido a dosagem de imunoglobulinas, que revelaram resultados normais.
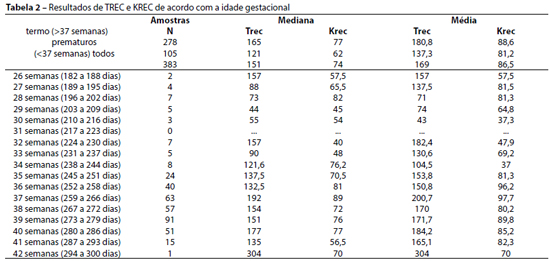
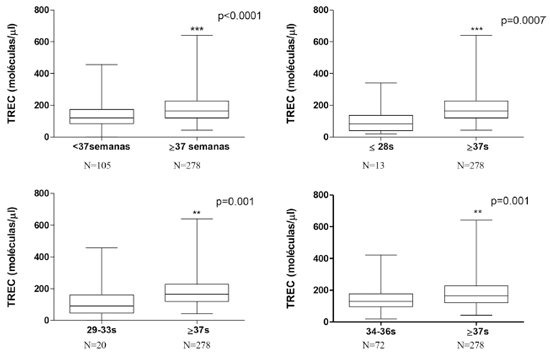
Ao avaliarmos os valores de TREC e KREC dos recém-nascidos de acordo com a idade gestacional, observamos nos prematuros uma mediana de 121 (média de 137.3±8.3) e 62 (média de 88,6±5.7) para valores de TREC e KREC, respectivamente. Nos recém-nascidos a termo, a mediana para os níveis de TREC foi de 165 (média de 180.8±5.3) e de 77 (média de 88.6±3.2) para KREC. As contagens de TREC e KREC foram significativamente maiores nos nascidos de termo.
Foi feita uma estratificação em grupos, considerando: prematuros extremos (menores de 28 semanas), moderados (entre 29 e 33 semanas), tardios (entre 34 e 36 semanas) e a termo (a partir de 37 semanas). Foram calculadas as médias e medianas dos resultados desses subgrupos divididos de acordo com a idade gestacional, separados por faixas de semanas, desde 26 até 42 (Tabela 2).
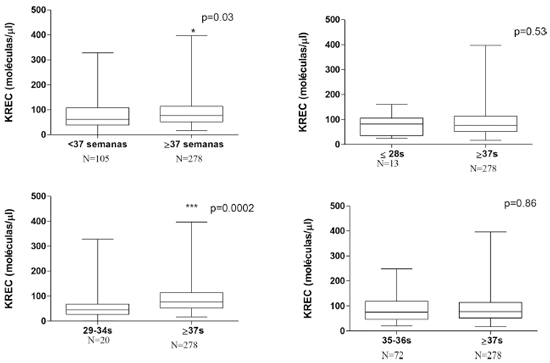
Em relação às análises de TREC, a mediana de contagem foi de 82 (média 104,7±24.9) para os prematuros extremos, 91 (média 121,5±23.2) para os prematuros moderados, 130 para os prematuros tardios (média 147,5±9.1) e 165 para os pacientes a termo (média 71,5±5.4), sendo observados níveis maiores de TREC nos RN a termo em relação a todos os grupos de prematuros (Figura 1). Já nas análises de KREC, a mediana de concentração foi de 82 (média 77,7±12.4) para os prematuros extremos, 45 (média 55,9±8.6) para os prematuros moderados, 71,5 para os prematuros tardios (média 88,9±7.6) e 77 para os pacientes a termo (média 88,6±3.2), sendo observada diferença estatisticamente significativa apenas entre o grupo dos prematuros moderados com os pacientes a termo (Figura 2).
As idades gestacionais foram expressas em semanas e a quantificação de KREC em moléculas por microlitro. Não houve diferença estatisticamente significativa entre os valores de prematuros extremos e tardios com os de termo. Valores menores de KREC foram observados nos grupos de prematuros moderados em relação a recém-nascidos a termo.
As idades gestacionais foram expressas em semanas e a quantificação de TREC em moléculas por microlitro. Valores maiores de TREC foram observados em recém-nascidos a termo.
DISCUSSÃO
A aplicação de um método de triagem neonatal que facilita a detecção precoce de casos suspeitos para erros inatos da imunidade foi um grande avanço na busca da melhora da sobrevida dos portadores dessas doenças, tendo sido gradualmente implementada nos Estados Unidos da América a partir de 2009.16 Desde então, outros países como Alemanha, Israel, Nova Zelândia, Suíça, Suécia, Itália, Finlândia e Japão passaram a realizar essa triagem global ou parcialmente.17
No Brasil, apenas sete anos depois do início da triagem nos EUA surgiu o primeiro estudo piloto usando a quantificação de TREC em papel filtro como triagem para SCID,13 porém este teste ainda não faz parte do programa nacional de triagem neonatal. Recentemente, foi aprovado projeto de lei (PL 5.043/2020) que amplia a lista de doenças detectadas na triagem neonatal do Sistema Único de Saúde brasileiro, incluindo a investigação para EII.
No presente estudo, foi realizada triagem neonatal com quantificação de TREC e KREC em recém-nascidos prematuros e a termo, sendo os resultados comparados entre os grupos. Apesar de o Rio de Janeiro ser uma das grandes metrópoles do país, esta foi a primeira vez que esse tipo de triagem foi realizado em uma maternidade pública da cidade.
Dentre os pacientes estudados, não foi diagnosticado nenhum recém-nascido com imunodeficiência, o que pode ter ocorrido devido ao tamanho amostral reduzido e à baixa incidência das doenças avaliadas pelas dosagens de TREC e KREC. Apesar disso, consideramos relevante a inclusão da quantificação de TREC e KREC para acessibilidade universal no programa de triagem neonatal. Foi demonstrado que a coleta em papel filtro pode ser uma forma viável para triagem de recém-nascidos do sistema público de saúde, já que não tem alto custo e permite que amostras coletadas em diferentes locais sejam enviadas pelo correio para o processamento em centros especializados, facilitando sua aplicação em diferentes estados brasileiros.
De acordo com a literatura, prematuros apresentam quantificações de TREC e KREC menores que os nascidos de termo.18 Os resultados encontrados são compatíveis com esses dados, uma vez que a mediana dos valores de TREC e KREC dos prematuros também foi menor do que nos nascidos a termo.
As dosagens dos RN prematuros foram repetidas quando estes já haviam completado mais de 37 semanas de idade gestacional corrigida, sendo a quantificação dos TREC e KREC nesse momento normal. Isso corrobora orientações prévias de que, quando a triagem é realizada logo após o nascimento em bebês prematuros, pode precisar ser repetida quando estes atingirem o termo em idade corrigida (casos que tiverem primeiros resultados alterados).19
Foi observado que os resultados não evidenciaram diferença significativa entre os valores de KREC de prematuros tardios (nascidos entre 34 e 36 semanas) e os nascidos a termo (acima de 37 semanas), portanto, sugerimos que recém-nascidos prematuros com KREC alterado poderiam ter a triagem repetida já a partir de 34 semanas de idade gestacional corrigida. Entretanto, um número maior de recém-nascidos deve ser avaliado para confirmar esses achados.
Na população estudada, quatro amostras tiveram dosagens de TREC abaixo de 25 unidades por microlitro, todas provenientes de recém-nascidos prematuros. Foram repetidas as dosagens de três desses pacientes, por meio de nova coleta quando completaram mais de 37 semanas de idade gestacional corrigida. Nessa segunda análise, a quantificação foi acima do valor de corte para todos os três pacientes. Não foi possível fazer a segunda análise em um dos pacientes, que faleceu antes do laudo da primeira amostra ser liberado. Tratava-se de um recém-nascido de 28 semanas de idade gestacional, que nasceu prematuro devido a complicações por transfusão feto-fetal. Era o primeiro gemelar, receptor, que se apresentava hidrópico, internado na UTI em estado grave desde o nascimento e que faleceu com oito dias de vida. A hidropsia fetal é descrita como causa de TREC abaixo do normal, assim como a prematuridade.20
Em relação ao KREC, cinco amostras tiveram dosagens abaixo de 20 unidades por microlitro, sendo que dois dos pacientes tiveram TREC e KREC alterados. Desses cinco exames, quatro eram de prematuros, que repetiram as dosagens por meio de nova coleta quando já tinham mais de 37 semanas de idade gestacional corrigida, e nessa nova análise a quantificação foi acima do valor de corte. O paciente, que já tinha mais de 37 semanas no momento do primeiro exame, repetiu a testagem imediatamente após o resultado da primeira amostra ser liberado, ainda no primeiro mês de vida, e a segunda análise foi normal.
Realizamos um estudo comparando as diferenças de quantificação de TREC e KREC não apenas entre prematuros e recém-nascidos a termo, mas também subdividindo em diferentes faixas de prematuridade. Comparamos os resultados de TREC e KREC de cada subgrupo dos menores de 37 semanas com os maiores. Em todas as comparações, foi confirmada que a quantificação de TREC nos RN a termo foi maior que nos prematuros, porém nas de KREC só houve diferença estatisticamente significativa entre o grupo de prematuros moderados com os nascidos a termo. Nosso achado é compatível com dados já descritos anteriormente: Borte et al. (2011) descreveram que, ao contrário da tendência esperada, os menores de 28 semanas apresentaram valor de KREC inesperadamente mais elevados que os prematuros entre 32 a 34 semanas. 21
CONCLUSÕES
Nossos resultados mostraram que a prematuridade é um fator que influencia nas dosagens de TREC e KREC; entretanto, valores considerados normais foram observados na grande maioria dos recém-nascidos prematuros, o que ressalta a possibilidade e a importância da realização do teste de triagem nesse grupo. Os dados sugerem que recém-nascidos com KREC baixo talvez possam ser reavaliados com 34 semanas, não necessitando esperar até completarem idade gestacional corrigida de termo.
É importante prosseguir com esse tipo de estudo, ampliando a amostra de recém-nascidos, tanto prematuros quanto a termo, de maneira a confirmar os resultados aqui apresentados.
REFERÊNCIAS
1. Bousfiha A, Jeddane L, Picard C, Al-Herz W, Ailal F, Chatila T, et al. Human Inborn Errors of Immunity: 2019 Update of the IUIS Phenotypical Classification. J Clin Immunol. 2020;40(1):66-81.
2. Tangye SG, Al-Herz W, Bousfiha A, Chatila T, Cunningham-Rundles C, Etzioni A, et al. Human Inborn Errors of Immunity: 2019 Update on the Classification from the International Union of Immunological Societies Expert Committee. J Clin Immunol. 2020;40(1):24-64.
3. Mamcarz E, Zhou S, Lockey T, Abdelsamed H, Cross SJ, Kang G, et al. Lentiviral Gene Therapy Combined with Low-Dose Busulfan in Infants with SCID-X1. N Engl J Med. 2019;380(16):1525-34.
4. Mazzucchelli JT, Bonfim C, Castro GG, Condino-Neto AA, Costa NM, Cunha L, et al. Severe combined immunodeficiency in Brazil: management, prognosis, and BCG-associated complications. J Investig Allergol Clin Immunol. 2014;24(3):184-91.
5. Goudouris ES, Segundo GRS, Poli C. Repercussions of inborn errors of immunity on growth. Jornal de Pediatria (Versão em Português). 2019;95:49-58.
6. Pai SY, Logan BR, Griffith LM, Buckley RH, Parrott RE, Dvorak CC, et al. Transplantation outcomes for severe combined immunodeficiency, 2000-2009. N Engl J Med. 2014;371(5):434-46.
7. Buckley RH. The long quest for neonatal screening for severe combined immunodeficiency. The Journal of allergy and clinical immunology. 2012;129(3):597-604; quiz 5-6.
8. Jacob CM, Castro APBM, Garnida EM. Agamaglobulinemia. Rev Bras Alergia e Imunopatologia. 2005;28(6):267-72.
9. McGhee SA, Kobayashi RH. What Does Screening Newborns for T-Cell Lymphopenia Find? The journal of allergy and clinical immunology In practice. 2017;5(5):1461-2.
10. Serana F, Chiarini M, Zanotti C, Sottini A, Bertoli D, Bosio A, et al. Use of V(D)J recombination excision circles to identify T- and B-cell defects and to monitor the treatment in primary and acquired immunodeficiencies. J Transl Med. 2013;11:119.
11. Kanegae MPP, Barreiros LA, Sousa JL, Brito MAS, Oliveira EBJ, Soares LP, et al. Newborn Screening for Severe Combined Immunodeficiencies Using Trecs and Krecs: Second Pilot Study in Brazil. Rev Paul Pediatr. 2017;35(1):25-32.
12. Kwan A, Abraham RS, Currier R, Brower A, Andruszewski K, Abbott JK, et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA. 2014;312(7):729-38.
13. Kanegae MP, Barreiros LA, Mazzucchelli JT, Hadachi SM, de Figueiredo Ferreira Guilhoto LM, Acquesta AL, et al. Neonatal screening for severe combined immunodeficiency in Brazil. J Pediatr (Rio J). 2016;92(4):374-80.
14. Borte M, Quinti I, Soresina A, Fernandez-Cruz E, Ritchie B, Schmidt DS, et al. Efficacy and safety of subcutaneous vivaglobin(R) replacement therapy in previously untreated patients with primary immunodeficiency: a prospective, multicenter study. J Clin Immunol. 2011;31(6):952-61.
15. Goldenberg RL, Culhane JF, Iams JD, Romero R. Epidemiology and causes of preterm birth. The Lancet. 2008;371(9606):75-84.
16. Meehan C, Bonfim C, Dasso JF, Costa-Carvalho BT, Condino-Neto A, Walter J. In Time: The Value and Global Implicationsof Newborn Screening Forsevere Combined Immunodeficiency. Rev Paul Pediatr. 2018;36(4):388-97.
17. Quinn J, Orange JS, Modell V, Modell F. The case for severe combined immunodeficiency (SCID) and T cell lymphopenia newborn screening: saving lives...one at a time. Immunol Res. 2020.
18. Baker MW, Laessig RH, Katcher ML, Routes JM, Grossman WJ, Verbsky J, et al. Implementing routine testing for severe combined immunodeficiency within Wisconsin's newborn screening program. Public Health Rep. 2010;125 Suppl 2:88-95.
19. Olbrich P, de Felipe B, Delgado-Pecellin C, Rodero R, Rojas P, Aguayo J, et al. A first pilot study on the neonatal screening of primary immunodeficiencies in Spain: TRECS and KRECS identify severe T- and B-cell lymphopaenia. Anales de Pediatría (English Edition). 2014;81(5):310-7.
20. Mauracher AA, Pagliarulo F, Faes L, Vavassori S, Gungor T, Bachmann LM, et al. Causes of low neonatal T-cell receptor excision circles: A systematic review. The journal of allergy and clinical immunology In practice. 2017;5(5):1457-60 e22.
21. Borte S, Wang N, Oskarsdottir S, von Dobeln U, Hammarstrom L. Newborn screening for primary immunodeficiencies: beyond SCID and XLA. Ann N Y Acad Sci. 2011;1246:118-30.