Número atual: 25(2) - Junho 2025
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo Original
Saúde auditiva infantil: estudo de dados da triagem auditiva em serviço de referência
Child hearing health: a study of hearing screening data in a referral service
Márcia Salgado Machado1; Adriana Laybauer Silveira Unchalo2; Cassandra Caye Anschau2; Débora Ruttke von-Saltiél2; Denise Saute Kochhann2; Karine da Rosa Pereira2; Adriane Ribeiro Teixeira2,3
DOI:10.31365/issn.2595-1769.2025.0317
1. Universidade Federal de Ciências da Saúde, Fonoaudiologia - Porto Alegre - RS - Brasil
2. Hospital de Clínicas de Porto Alegre, Serviço de Fonoaudiologia - Porto Alegre - RS - Brasil
3. Universidade Federal do Rio Grande do Sul, Departamento de Saúde e Comunicação Humana - Porto Alegre - RS - Brasil
Endereço para correspondência:
Instituição: Universidade Federal de Ciências da Saúde, Porto Alegre, RS, Brasil
Recebido em: 30/03/2024
Aprovado em: 30/12/2024
Resumo
INTRODUÇÃO: Sabe-se que os programas de saúde auditiva materno-infantil apresentam inúmeros desafios na tentativa de garantir a intervenção precoce para crianças com deficiência auditiva e, portanto, torna-se essencial analisar os resultados observados nas suas diferentes etapas.
OBJETIVO: Analisar dados da etapa de triagem auditiva neonatal de um serviço de referência do sul do país.
MÉTODOS: Trata-se da análise de dados secundários da triagem auditiva neonatal realizada em um serviço de referência em saúde auditiva no período de janeiro de 2018 a abril de 2020. Foram analisadas as seguintes variáveis: sexo do neonato, presença de indicador de risco para a deficiência auditiva infantil, local, método e resultado da triagem auditiva neonatal (passa/falha).
RESULTADOS: Dos 4.128 neonatos incluídos no estudo, 3.568 (86,4%) passaram e 560 (13,6%) falharam na triagem. A técnica mais utilizada foi o teste de emissões otoacústicas evocadas transientes, bem como a unidade de internação obstétrica foi o local de maior prevalência para realização da triagem. Observou-se maior prevalência de falha em bebês com indicadores de risco para deficiência auditiva. Os neonatos do sexo feminino apresentaram redução na prevalência de falha na triagem auditiva neonatal.
CONCLUSÕES: Os dados analisados estão de acordo com a literatura vigente em termos de prevalência de IRDA, falha na TAN, técnicas e locais da TAN e as correlações desses aspectos.
Palavras-chave: Neonato. Audição. Triagem neonatal. Perda auditiva.
Abstract
INTRODUCTION: It is known that maternal and child hearing health programs present numerous challenges in an attempt to ensure early intervention for children with hearing loss and, therefore, it is essential to analyze the results observed in their different stages.
OBJECTIVE: To analyze data from the neonatal hearing screening stage of a reference service in the south of the country.
METHODS: This is the analysis of secondary data of neonatal hearing screening performed at a reference service in hearing health from January 2018 to April 2020. The following variables were analyzed: baby's sex, presence or absence risk indicators for childhood hearing loss, location, method and outcome of newborn hearing screening (pass/fail).
RESULTS: Of the 4,128 neonates included in the study, 3,568 (86.4%) passed and 560 (13.6%) failed screening. The most used technique was the transient evoked otoacoustic emissions test, and the obstetric inpatient unit was the most prevalent place for screening. A higher prevalence of failure was observed in babies with risk indicators for hearing loss. Female neonates showed a reduction in the prevalence of failure in neonatal hearing screening.
CONCLUSIONS: The analyzed data are in agreement with the current literature in terms of risk indicators for childhood hearing loss prevalence, neonatal hearing screening failure, techniques and as correlations of these aspects.
Keywords: Newborn. Hearing. Neonatal screening. Hearing loss.
INTRODUÇÃO
A audição é essencial para a aquisição da linguagem oral e desempenha papel fundamental na integração da criança com o meio exterior.1,2 Sabe-se que o desempenho linguístico e social de crianças com deficiência auditiva é significativamente melhor quando a intervenção terapêutica se inicia antes dos seis meses de idade, comparadas a crianças que iniciaram o processo terapêutico após esta idade.3
Nesse contexto, torna-se evidente que o futuro de uma criança deficiente auditiva depende da identificação precoce da deficiência, seguida pela intervenção imediata e adequada,4 o que torna o diagnóstico precoce da deficiência auditiva infantil essencial, uma vez que evita que a criança sofra os efeitos da falta de estimulação auditiva.5
Estima-se que cerca de 12,4 milhões de pessoas (6,2% da população brasileira) apresente algum tipo de incapacidade para enxergar, ouvir, mover-se ou manifeste alguma deficiência física e mental. Dentre elas, a deficiência auditiva é a terceira mais frequente no país (representando 1,1% das ocorrências), atingindo 1,4% de prevalência na Região Sul do país.6
Destaca-se, ainda, que a prevalência da deficiência auditiva varia de 1-6 neonatos para cada mil nascidos vivos, e de 1-4 para cada 100 recém-nascidos provenientes de Unidade de Terapia Intensiva Neonatal (UTIN).7,8 No Brasil, um estudo identificou prevalência de perda auditiva congênita permanente de 2:1.000 nascidos vivos, aumentando para 18,6/1.000 em bebês com indicadores de risco para a deficiência auditiva infantil.9
As últimas décadas registram a expansão aceleradas de programas que incluem a triagem auditiva neonatal (TAN) e a intervenção precoce pelo mundo.10 No Brasil, após inúmeros esforços isolados para a aprovação de leis municipais de regulamentação da TAN,11 foi sancionada uma lei federal em 2010, a qual torna a realização da TAN por meio de emissões otoacústicas (EOA) obrigatória e gratuita em todos os hospitais e maternidades do Brasil.12 Desde então, esforços institucionais e governamentais têm sido realizados para estabelecer, integrar e aperfeiçoar os mecanismos referentes a identificação, diagnóstico e intervenção em casos de perda auditiva na infância.7,13
Diversos comitês recomendam a TAN como procedimento inicial dos programas de detecção e intervenção precoce da deficiência auditiva infantil.14,15,16,17 Recomenda-se que a TAN seja realizada, preferencialmente, nos primeiros dias de vida e, no máximo, até o final do primeiro mês de vida por meio de medidas fisiológicas. Se ocorrer falha, o bebê deve ser retestado e, na persistência da falha, deve ser submetido à avaliação otorrinolaringológica e audiológica complementar até, no máximo, três meses de vida. Nos casos de confirmação do diagnóstico da perda auditiva, deve ser iniciada intervenção terapêutica adequada até os seis meses de idade.15,16,17 No entanto, sabe-se que o diagnóstico da perda auditiva no Brasil ainda é tardio,18 uma vez que o intervalo entre a suspeita da deficiência auditiva pelos familiares, o diagnóstico audiológico e a intervenção ainda é muito longo.19
Tendo em vista os inúmeros desafios observados na tentativa de garantir a intervenção precoce para crianças com deficiência auditiva, torna-se essencial analisar os resultados observados nas diferentes etapas dos programas de saúde auditiva materno-infantil. Portanto, o objetivo deste estudo é analisar dados da etapa de triagem auditiva neonatal de um serviço de referência do sul do país em relação aos seguintes aspectos: presença de indicador de risco para deficiência auditiva (IRDA), resultados de passa/falha, técnica utilizada, local de realização e suas correlações com os resultados na TAN.
METODOLOGIA
Trata-se de um estudo retrospectivo, observacional, seccional, de prevalência, no qual foram analisados os dados da etapa de triagem auditiva neonatal do Programa de Saúde Auditiva Materno-infantil do Hospital de Clínicas de Porto Alegre (HCPA). Nesse serviço, os neonatos foram classificados pela presença ou ausência de IRDA para realização de protocolo específico.
Os bebês sem IRDA que passaram na TAN receberam orientações gerais sobre saúde auditiva e tiveram alta. No entanto, os que falharam foram encaminhados para reteste em até 30 dias, no qual receberam orientações e alta nos casos de "passa". Os que falharam foram encaminhados para diagnóstico audiológico e permaneceram no serviço para procedimentos de intervenção precoce quando a perda auditiva foi confirmada.
Na presença de IRDA, os bebês realizaram TAN com PEATE-A e, em caso de falha, foram encaminhados imediatamente para o serviço de diagnóstico (sem etapa de reteste). Os que passaram receberam orientações de saúde auditiva. Para todos os bebês que falharam em qualquer etapa do protocolo, foi realizada estratégia de busca ativa com chamamento de retorno via ligação telefônica ou telegrama enviado pelo Hospital.
O estudo consistiu na análise de dados secundários realizada por meio da consulta a um banco de dados do Serviço de Fonoaudiologia do HCPA (disponível em planilha Excel®), o qual continha dados da triagem auditiva neonatal realizada nesse hospital no período de janeiro de 2018 a abril de 2020, de acordo com o fluxo descrito.
As seguintes variáveis foram analisadas: sexo do bebê, presença ou ausência de IRDA (conforme recomendação do COMUSA, 201017), local de realização da TAN (unidade de internação obstétrica, unidade de terapia intensiva neonatal, ambulatório), método de realização da TAN (emissões otoacústicas evocadas transientes-EOAT, potenciais evocados auditivos de tronco encefálico automático - PEATE-A ou técnica combinada dos dois procedimentos), resultado na TAN (passa = resultado normal em ambas as orelhas, falha = resultado alterado em uma ou em ambas as orelhas). Os registros que não apresentaram essas variáveis de forma completa foram excluídos da análise.
Após a exclusão dos dados incompletos, realizou-se a análise estatística. Os dados foram analisados no programa SPSS, versão 28.0, Chicago, IL, USA, com um nível de significância de 5%. Para comparação de proporções, o teste qui-quadrado de Pearson complementado pela análise dos residues ajustados (para variáveis politômicas) foi aplicado. Para controle de fatores confundidores, o modelo de regressão de Poisson foi utilizado. Nesta análise, a razão de prevalências (RP) e seu respectivo intervalo de 95% de confiança foram calculados.
Em relação aos aspectos éticos para pesquisa em seres humanos, destaca-se que o presente estudo foi realizado de acordo com as orientações do Conselho Nacional da Saúde na Resolução 466/12, bem como foi aprovado pelo Comitê de Ética em Pesquisa da instituição.
RESULTADOS
O banco de dados analisado continha 6.608 registros de TAN. Após a exclusão dos registros incompletos, foram incluídos 4.128 nesta análise.
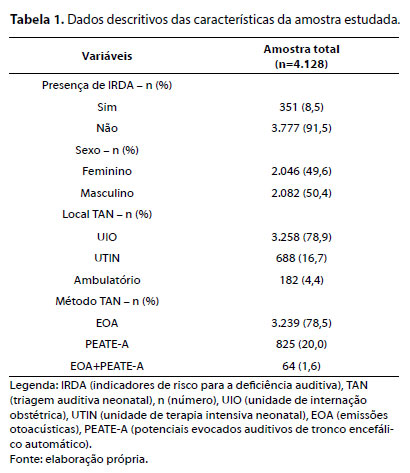
A Tabela 1 apresenta as características da amostra estudada em relação às seguintes variáveis: presença de IRDA, sexo, local de realização da TAN e método utilizado para a TAN.
Dos 4.128 neonatos incluídos nesta análise, 3.568 (86,4%) passaram na TAN e 560 (13,6%) falharam na TAN (Gráfico 1).

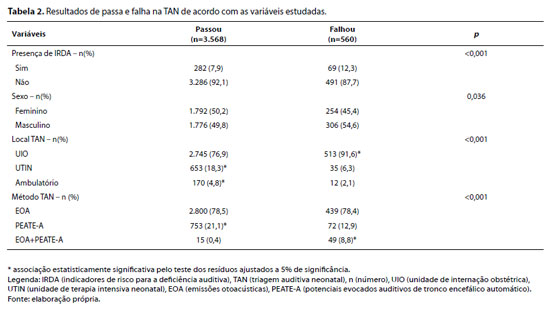
Os resultados obtidos na TAN e suas correlações com as variáveis estudadas podem ser observados na Tabela 2.
A análise estatística realizada demonstrou que a presença de IRDA aumenta em 51,2% a prevalência de falha na TAN (RP= 1,512; IC= 95%: 1,205 a 1,898; p<0,001). Quando ajustado para o sexo, a associação permanece estatisticamente significativa (RP= 1,506; IC= 95%: 1,200 a 1,891; p<0,001). Por outro lado, quando ajustado pela presença de IRDA, o sexo também permanece em fator estatisticamente associado à falha na TAN, sendo que os neonatos do sexo feminino apresentaram redução de 15,2% na prevalência de falha na TAN (RP= 0,848; IC= 95%: 0,726 a 0,990; p<0,036).
Em relação ao método e o local de realização da TAN, a Tabela 3 apresenta a prevalência da realização das técnicas de TAN em cada local.
DISCUSSÃO
O presente estudo analisou um banco de dados secundários com informações da TAN em um serviço de referência do sul do país. Um aspecto a ser destacado é a falta de registros completos de 2.480 neonatos, o que representou uma perda de 37,53% da amostra. Sabe-se que os indicadores de qualidade dos programas de detecção e intervenção precoce devem ser monitorados e avaliados periodicamente.20 Para tanto, a coleta de dados é importante para compreender e modificar o que for necessário para a melhoria do programa. No entanto, esse registro pode ser difícil em alguns países, dificultando a cobertura e a qualidade dos programas entre as regiões.21 Por esse motivo, após a realização deste estudo, o serviço iniciou a reformulação do banco de dados utilizado, o qual é atualmente utilizado de forma sistemática para o registro completo das informações referentes a TAN e todos os processos subsequentes de diagnóstico e intervenção.
Os resultados gerais da TAN demonstraram falha na TAN em 13,6% da amostra estudada. Tal achado foi semelhante a outros estudos realizados no Brasil, o qual observou prevalência de falha na TAN entre 10-17,3%.22-24 Recomenda-se que o índice de encaminhamentos para diagnóstico audiológico não ultrapasse 4%.7,16,17,25 No entanto, para este estudo, foram analisados apenas os registros da triagem auditiva inicial, a qual deve ser refeita nos casos de falha antes do encaminhamento para diagnóstico. Dessa forma, o índice de falha encontrado não reflete os encaminhamentos para avaliação diagnóstica, pois o reteste foi indicado para todos os neonatos que obtiveram falha.
Em relação aos dados analisados, verificou-se uma amostra homogênea em relação ao sexo (49,6% feminino e 50,4% masculino). No entanto, os neonatos do sexo feminino demonstraram um efeito protetor para falha na TAN (prevalência de falha 15,2% inferior em relação ao sexo masculino). Apesar de serem dados apenas da TAN inicial, é válido ressaltar que a prevalência de perda auditiva moderada a grave é ligeiramente maior entre homens do que entre mulheres,20 o que pode justificar os achados obtidos.
Quanto à presença de IRDA, verificou-se prevalência em 8,5% da amostra. Observou-se falha na TAN em 13% dos neonatos com IRDA, sendo que a presença dessa condição aumentou significativamente a prevalência de falha na TAN. Trata-se de um achado previsível, visto que a prevalência de perda auditiva pode aumentar em até 10 vezes nos neonatos com IRDA.16 Cabe ressaltar que não foi possível identificar os IRDA apresentados por cada neonato, pois não havia critérios estabelecidos para registro dessas informações. Por esse motivo, o banco de dados atual também foi readequado para o registro detalhado das informações sobre os IRDA, de acordo com as diretrizes do Joint Committee on Infant Hearing.16
Quanto ao local de realização da TAN, observou-se prevalência na UIO (78,9%), corroborando achados de um estudo brasileiro, no qual 76,5% dos neonatos foram triados no alojamento conjunto.23 Além disso, os comitês nacionais e internacionais recomendam que a TAN deve ser realizada idealmente na maternidade antes da alta hospitalar.7,16,17
No que tange à técnica utilizada para realização da TAN, o teste de EOAT foi o mais utilizado (78,5%), da mesma forma que um estudo brasileiro.26 Vários aspectos podem ser citados para o predomínio das EOAT na triagem inicial, tais como: recomendação para TAN em neonatos sem indicadores de risco e/ou provenientes do alojamento conjunto,7,16,17 ser o procedimento citado na Lei Federal n. 12.303 para realização da TAN no Brasil,12 identificação de perdas auditivas cocleares de até 35dBNA,17 menor custo21 e maior rapidez de execução em relação ao PEATE-A.
Por outro lado, verificou-se prevalência significativa de falha na TAN quando realizada na UIO, fato que pode ser justificado pelas conhecidas alterações em nível de orelha externa e/ou média que podem interferir nos resultados das EOAT (técnica mais usada no local). Dessa forma, sabe-se que, apesar das inúmeras vantagens do uso das EOAT na TAN, a escolha desse método pode provocar maior taxa de falhas no período pós-parto imediato.27
Vale destacar que a técnica mais utilizada na UTIN foi o PEATE-A, o que está de acordo com as diretrizes dos comitês especializados.7,16,17 Somado a isso, houve 5,1% de falha na TAN em bebês triados na UTIN, índice inferior ao obtido na UIO. Neste sentido, o aspecto temporal da realização da TAN nos neonatos da UTI pode interferir nesse achado, já que os neonatos são triados quando já estão com mais dias (ou meses) de vida e, consequentemente, têm menor interferência de alterações na orelha externa e/ou média comuns no pós-parto. Ademais, o uso do PEATE-A como método prioritário minimiza os resultados falso-positivos e, portanto, o índice de falha encontrado pode ter ocorrido pela soma dos aspectos citados.
Em relação às técnicas para TAN, as EOAT e o PEATE-A fornecem registros não invasivos sobre a função auditiva. No entanto, são distintos em relação às estruturas envolvidas, uma vez que as EOAT demonstram o funcionamento das células ciliadas externas da cóclea, enquanto o PEATE-A reflete a função coclear e do tronco encefálico.28 Além disso, o limiar auditivo detectado no PEATE-A é superior ao das EOA, o que pode interferir na detecção de alterações de menor grau. Por outro lado, apesar de detectarem alterações de menor grau (30 a 35dB), as EOA não detectam neuropatia auditiva.29
Verificou-se, ainda, que 4,4% dos neonatos foram triados no ambulatório após a alta da maternidade. Isso ocorreu pela ausência de cobertura da TAN em alguns dias da semana, o que é um aspecto comumente observado pela falta de recursos humanos nas instituições públicas. Por outro lado, verificou-se prevalência significativa de resultado "passa" na TAN realizada no nível ambulatorial. Isso pode ser justificado pelo fato de o teste ser realizado dias após o nascimento, o que reduz significativamente os índices de falso-positivos, devido aos aspectos já descritos. Ressalta-se que a TAN deve ser realizada idealmente antes da alta da maternidade ou até o final do primeiro mês de vida.16
Por fim, destaca-se que a prevalência acelerada de perda auditiva incapacitante exige melhorias nos programas de TAN.21 Todos os esforços devem ser realizados para que as crianças com perda auditiva tenham a chance de um desenvolvimento adequado. Por isso, é fundamental garantir que todas as etapas dos programas ocorram em tempo hábil, visto que a literatura já demonstrou melhor desenvolvimento de crianças com intervenção precoce em relação às que têm diagnóstico tardio3.
Apesar de a cobertura da TAN no Brasil ter evoluído cerca de 180% na última década,30 ainda é necessário criar sistemas de rastreamento adequados com transferência bidirecional de dados.21 Soma-se a isso a necessidade de sistemas de notificação obrigatória, a exemplo do programa desenvolvido em Israel, que impulsionou a cobertura da TAN, a idade do diagnóstico e da intervenção para crianças com perda auditiva.25
Os dados aqui apresentados são restritos à etapa de TAN e não incluíram informações a respeito das demais etapas do programa para este estudo. Dessa forma, devido à limitação de registros unificados sobre as etapas do programa de saúde auditiva, não foi possível estabelecer os indicadores de qualidade do serviço. Tal fato também impediu a investigação das possíveis causas da perda auditiva nos bebês com diagnóstico confirmado, bem como a verificação de sua prevalência na população estudada. Por outro lado, apesar das limitações apresentadas, o estudo foi fundamental para impulsionar mudanças cruciais na coleta dos dados e no registro de todas as informações em protocolo unificado.
Nesse sentido, destaca-se que a análise das lacunas observadas promoveu modificações que já foram adotadas no local. O fluxo e o registro de todas as etapas do programa foram reorganizados para facilitar a identificação dos IRDA ao nascimento e o registro detalhado dos resultados obtidos desde a TAN até a intervenção nos casos de perda auditiva confirmada. Esse novo formato possibilitou o melhor gerenciamento dos indicadores de qualidade e tem sido periodicamente analisado pela coordenação do programa.
CONCLUSÕES
O estudo demonstrou que os dados analisados estão de acordo com a literatura vigente em termos de prevalência de IRDA, falha na TAN, técnicas e locais da TAN e as correlações desses aspectos. No entanto, melhorias no processo de coleta e registro de dados são necessárias para viabilizar o gerenciamento adequado dos dados do programa no serviço. Além disso, os dados obtidos reiteram a necessidade de uma programação de reteste nos portadores de IRDA, utilizando-se EOA e PEATE-A.
Referências
1. Boscatto SD, Machado MS. Teste da orelhinha no Hospital São Vicente de Paulo: levantamento de dados. Rev. CEFAC. 2013;15(5):1118-1124.
2. Gato CI, Tochetto TM. Deficiência auditiva infantil: implicações e soluções. Rev. CEFAC. 2007;9(1):110-115.
3. Yoshinaga-Itano C, Sedey AL, Coulter DK, et al. Language of early and later-identified children with hearing loss. Pediatrics. 1998;102:1161-1171.
4. Alvarenga KF, Gadret JM, Araújo ES, Bevilacqua MC. Triagem auditiva neonatal: motivos da evasão das famílias no processo de detecção precoce. Rev. Soc. Bras. Fonoaudiol. 2012;17(3):241-247.
5. Russo ICP, Santos TMM. Audiologia infantil. 4.ed. São Paulo: Cortez; 2009. 231p.
6. Instituto Brasileiro de Geografia e Estatística. Diretoria de Pesquisa. Coordenação de trabalho e rendimento. Pesquisa Nacional de Saúde. Rio de Janeiro: IBGE; 2013.
7. Brasil. Ministério da Saúde: Diretrizes de atenção da triagem auditiva neonatal. Brasília; 2012. Disponível em: file:///C:/Users/Marcia%20Machado/Downloads/diretrizes_atencao_triagem_auditiva_neonatal.pdf. Acesso em: 21 jun. 2022.
8. Lima GML, Marba ST, Santos MF. Hearing screening in a neonatal intensive care unit. J Pediatr. 2006;82(2):110-114.
9. Anastasio ART, Yamamoto AY, Massuda ET, Manfredi AKS, Cavalcante JMS, Lopes BCP, et al. Comprehensive evaluation of risk factors for neonatal hearing loss in a large Brazilian cohort. Journal of Perinatology. 2021 Feb;41(2):315-23.
10. Pimperton H, Kennedy Cr. The impact of early identification of permanent childhood hearing impairment on speech and language outcomes. Archives of disease in childhood. 2012;97(7):648-53.
11. Tochetto T, Vieira EP. Legislação brasileira sobre triagem auditiva neonatal. Barueri, SP: Pró-Fono; 2006. 57p.
12. Brasil. Presidência da República. Lei 12.3030/2010 (Lei ordinária) 02/08/2010. Disponível em http://www.planalto.gov.br/ccivil_03/_ato2007-2010/2010/lei/l12303.htm Acesso em: 20 jun. 2022.
13. Governo do Estado do Rio Grande do Sul. Secretaria Estadual de Saúde. Plano Estadual de Prevenção, Tratamento e Reabilitação Auditiva. 2005. Disponível em: http://www1.saude.rs.gov.br/dados/1248296018580Plano%20Estadual%20de%20Sa%FAde%20Auditiva.pdf Acesso em: 20 jun. 2022.
14. Comitê Brasileiro sobre Perdas Auditivas na Infância (CBPAI). Recomendação 01/99. J Con Fed Fonoaudiol. 2000;5:3-7.
15. Joint Committee on Infant Hearing (JCIH). Year 2007 Position Statement: principles and guidelines for early hearing detection and intervention programs. Pediatrics. 2007:898-921.
16. Joint Committee on Infant Hearing. Year 2019 Position Statement: Principles and Guidelines for Early Hearing Detection and Intervention Programs. The Journal of Early Hearing Detection and Intervention. 2019;4(2):1-44.
17. Lewis DR. Multiprofessional committee on auditory health: COMUSA. Brazilian Journal of Otorhinolaryngology. 2010;76(1);121-128.
18. Silva ARA, Silveira AK, Curado NRPV, Muniz LF, Griz SMS. Acompanhamento em programas de saúde auditiva infantil: uma revisão integrativa. Rev. CEFAC. 2014;6(3):992-1003.
19. Pinto MM, Raimundo JC, Samelli AG et al. Idade no diagnóstico e no início da intervenção de crianças deficientes auditivas em um serviço público de saúde auditiva brasileiro. Int Arq Otorhinolaryngology. 2012;16(1):44-9.
20. World Report on Hearing. Geneva: World Health Organization; 2021. Licence: CC BY-NC-SA 3.0 IGO. Disponível em file:///E:/Downloads/9789240020481-eng%20(3).pdf Acesso em: 25 jun. 2022.
21. Neumann K, Chadha S, Tavartkiladze G, Bu X, White KR. Newborn and Infant Hearing Screening Facing Globally Growing Numbers of People Suffering from Disabling Hearing Loss. Int. J. Neonatal Screen. 2019;5(7).
22. Barreira-Nielsen C, Futuro Neto HA, Gattaz G. Processo de implantação de Programa de Saúde Auditiva em duas maternidades públicas. Rev Soc Bras Fonoaudiol. 2007;12(2):99-105.
23. Botelho MSN, Silva VB, Arruda LS, Kuniyoshi IC, Oliveira LLR, Oliveira AS. Caracterização da triagem auditiva neonatal da Clínica Limiar em Porto Velho - Rondônia Braz. J. otorhinolaryngol. 2010;76(5).
24. Michelon F, Rockenbach SP, Floriano M, Delgado SE, Barba MC. Triagem auditiva neonatal: índice de passa/falha com relação a sexo, tipo de parto e tempo de vida. Rev. CEFAC. 2013;15(5).
25. Wasser J, Roth DA-E, Herzberg O, Lerner-Geva L, Rubin L. Assessing and monitoring the impact of the national newborn hearing screening program in Israel. Isr J Health Policy Res. 2019;8(1):30.
26. Cavalcanti HG, de Melo LP, Buarque LF, Guerra RO. Overview of newborn hearing screening programs in Brazilian maternity hospitals. Braz J Otorhinolaryngol. 2014;80:346-53.
27. Van Dyk M, Swanepoel DW, Hall JW. Outcomes with OAE and AABR screening in the first 48h: Implications for newborn hearing screening in developing countries. International Journal of Pediatric Otorhinolaryngology. 2015;79(7):1034-40.
28. Norton SJ, Gorga MP, Widen JE, Folsom RC, Sininger Y, Cone-Wesson B, et al. Identification of neonatal hearing impairment: Evaluation of transient evoked otoacoustic emission, distortion product otoacoustic emission, and auditory brain stem response test performance. Ear & Hearing, 2000;21(5):508-28.
29. Johnson JL, White KR, Widen JE, Gravel JS, James M, Kennalley T, et al. A multicenter evaluation of how many infants with permanent hearing loss pass a two-stage otoacoustic emissions/automated auditory brainstem response newborn hearing screening protocol. Pediatrics, 2005;116(3):663-72.
30. Oliveira TS, Dutra MRP, Cavalcanti HG. Triagem Auditiva Neonatal: associação entre a cobertura, oferta de fonoaudiólogos e equipamentos no Brasil. CoDAS 2021;33(2):e20190259.